En el laboratorio, o en tu propio cuerpo, tienes una mezcla de reactivos que, termodinámicamente, deberían reaccionar para formar productos estables. El problema es que, a menudo, esta reacción no ocurre inmediatamente.
¿Qué lo detiene? Un muro energético invisible llamado Energía de Activación (\(\mathbf{E_a}\)).
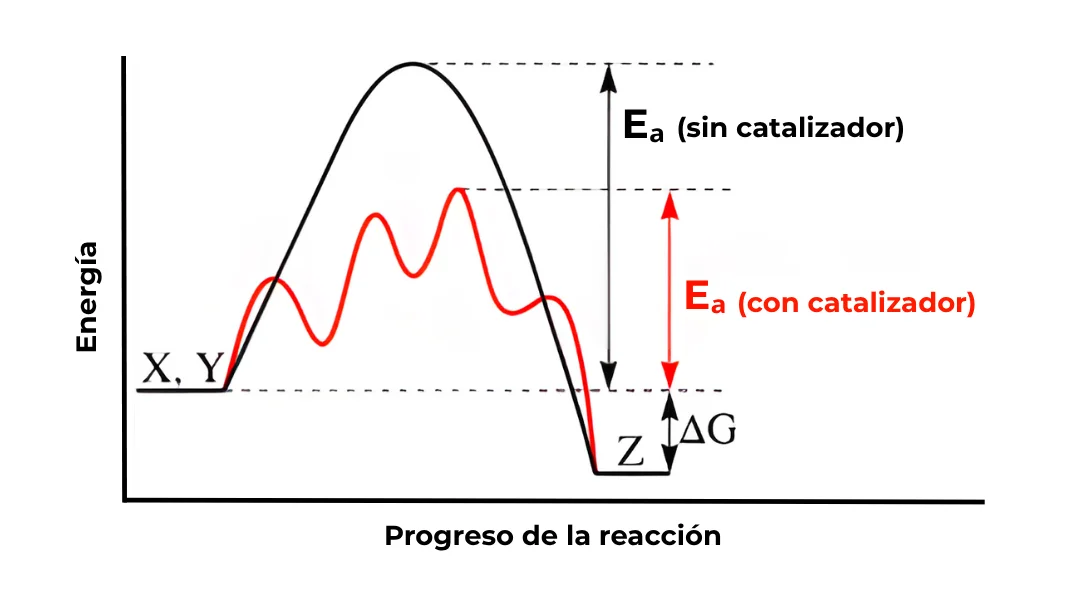
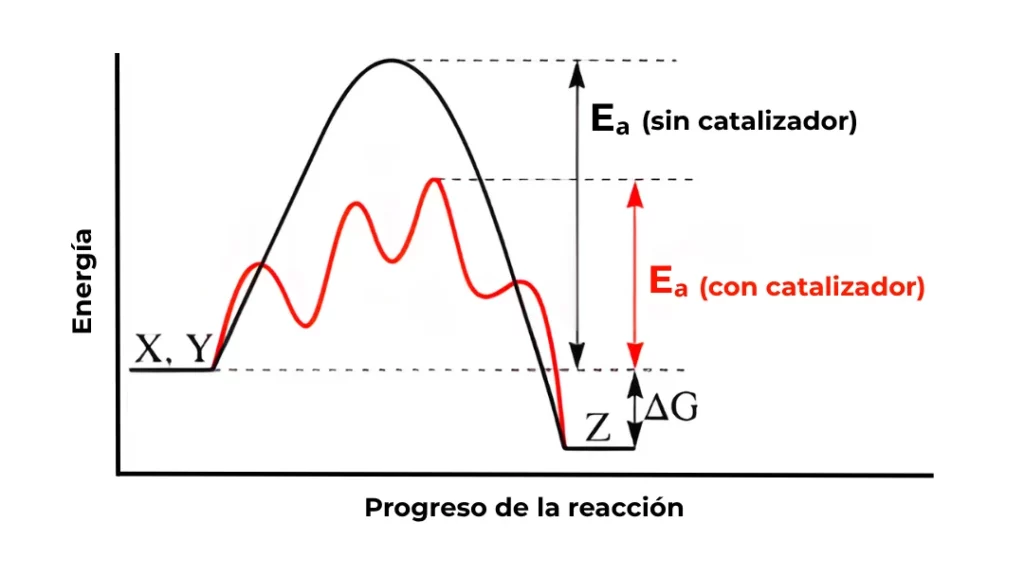
La Energía de Activación es la barrera energética mínima que debe superarse para que una reacción química tenga lugar. Es la «patada inicial» que necesitan los reactivos para romper sus enlaces y alcanzar el estado de transición, antes de formar nuevos productos.
Imagina que estás empujando una roca montaña arriba para que luego ruede libremente cuesta abajo. Aunque la roca acabará en una posición de menor energía (el producto es más estable), primero tienes que invertir energía para llevarla a la cima. Esa energía es la \(\mathbf{E_a}\).
Una reacción que termodinámicamente es favorable (exergónica) puede ser extremadamente lenta si su Energía de Activación es alta. En este punto es donde la catálisis entra en juego.
El Hack Químico: Cómo Actúan los Catalizadores
Un catalizador es una sustancia que acelera una reacción química sin consumirse en el proceso. Su mecanismo de acción es simple pero profundo:
Un catalizador acelera la reacción al proporcionar un camino alternativo con una Energía de Activación (\(\mathbf{E_a}\)) significativamente menor.
El catalizador no cambia la termodinámica global de la reacción (el \(\Delta G\)), ni el punto de equilibrio. Simplemente abre un «atajo» cinético.
Observa el diagrama de energía: el catalizador (la línea roja) reduce la altura de la barrera (\(\mathbf{E_a}\)), permitiendo que una mayor cantidad de moléculas de reactivo la superen en un momento dado.
La Ecuación Clave
La dependencia de la velocidad de reacción con la Energía de Activación se describe mediante la Ecuación de Arrhenius.
Donde:
- \(k\) es la constante de velocidad.
- \(E_a\) es la Energía de Activación.
Conclusión: Una pequeña disminución en la \(E_a\) (gracias al catalizador) provoca un aumento exponencial de la velocidad de reacción (\(k\)).
Tres Tipos de Catálisis:
Los catalizadores son esenciales en todos los niveles, desde el laboratorio hasta la vida celular.
1. Catálisis Heterogénea
El catalizador está en una fase diferente a los reactivos (generalmente un sólido).
- Ejemplo Industrial: El convertidor catalítico de un coche. Utiliza metales (platino, paladio) para acelerar la conversión de gases tóxicos (\(\text{NO}_x\), \(\text{CO}\)) en sustancias menos dañinas (\(\text{N}_2\), \(\text{CO}_2\)) en su superficie.
2. Catálisis Homogénea
El catalizador y los reactivos están en la misma fase (generalmente líquidos o gases).
- Ejemplo Común (Ácido-Base): La hidrólisis de un éster en agua se acelera con la adición de un ácido (\(\text{H}^+\)). Los catalizadores ácido-base donan o aceptan protones para estabilizar el estado de transición y reducir la \(\mathbf{E_a}\).
3. La Obra Maestra: Catálisis Enzimática (Biocatálisis)
Es la catálisis de la vida. Las enzimas son catalizadores biológicos (proteínas).
- ¡Dato Impresionante! Las enzimas son tan eficientes que pueden acelerar reacciones vitales hasta \(10^{20}\) veces (un 1 seguido de 20 ceros) en comparación con la reacción sin catalizar.
- Ejemplo Fundamental: La enzima amilasa en tu saliva descompone el almidón. Sin esta aceleración, tardarías años en digerir una simple patata.
La Catálisis es la Columna Vertebral del Mundo
El impacto de la catálisis va mucho más allá de la digestión:
- Fertilizantes y Alimentos: El Proceso Haber-Bosch utiliza catalizadores de hierro para la síntesis de amoníaco. Esta reacción crucial es la base de los fertilizantes que sostienen la alimentación de miles de millones de personas.
- Sostenibilidad y Energía: El desarrollo de nuevos catalizadores selectivos es clave para la química verde, permitiendo reacciones más limpias y eficientes, y optimizando la producción de combustibles y energía de hidrógeno.
- Fármacos: Prácticamente todos los medicamentos complejos pasan por pasos de síntesis que requieren catalizadores para asegurar la pureza y el rendimiento.
La catálisis nos permite manipular la cinética de las reacciones, controlando la velocidad de la naturaleza para sostener la vida y la civilización.