En 1927, Werner Heisenberg formuló uno de los principios más profundos de la mecánica cuántica: existen límites fundamentales a lo que podemos conocer simultáneamente sobre una partícula. El ejemplo más famoso es el par posición-momento: cuanto más precisamente midamos dónde está una partícula, menos sabremos sobre hacia dónde se mueve.
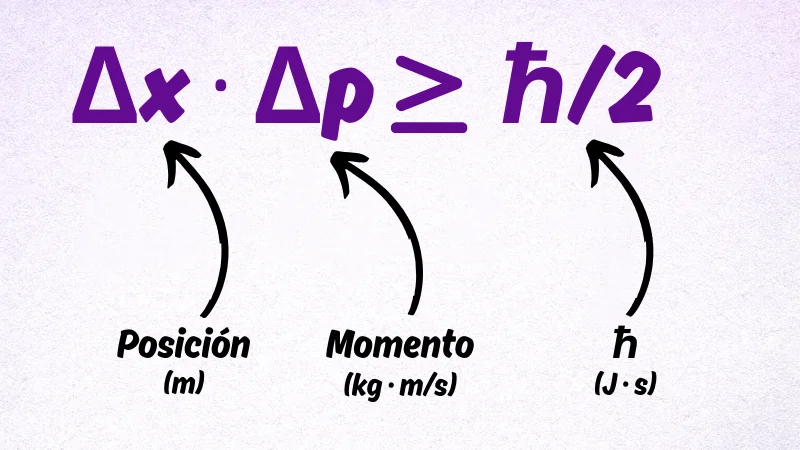
La desigualdad matemática
El principio se expresa como:
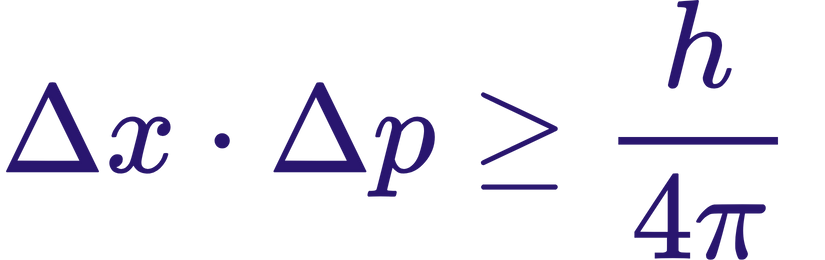
donde:
-
Δx: incertidumbre en la posición
-
Δp: incertidumbre en el momento
-
ħ: constante de Planck reducida (ħ = h/2π)
¿Por qué existe este límite?
La incertidumbre no es un defecto de nuestros instrumentos, sino una consecuencia de la naturaleza dual onda-partícula. Localizar una partícula requiere una onda muy concentrada (posición precisa), pero esto implica muchas frecuencias diferentes (momento incierto).
Consecuencias y aplicaciones
-
Fin del determinismo: Imposibilidad de predecir trayectorias exactas.
-
Estabilidad atómica: Los electrones no colapsan al núcleo porque la localización precisa aumentaría su energía cinética.
-
Tecnologías cuánticas: Láseres, microscopios electrónicos, resonancia magnética…
Otras relaciones de incertidumbre
Existen pares similares, como energía-tiempo (ΔE ⋅ Δt ≥ ħ/2), crucial para entender la creación de partículas virtuales o la evolución de sistemas cuánticos.
Una nueva filosofía de la ciencia
Como dijo Heisenberg: «Lo que observamos no es la naturaleza en sí, sino la naturaleza expuesta a nuestro método de interrogación.» El principio nos recuerda que en el mundo cuántico, observador y observado forman una unidad inseparable.